Conoscere le proprietà della tavola periodica e come variano è di fondamentale importanza per poter svolgere molti quiz di Chimica in vista del test d’ingresso a Medicina. Tali proprietà variano lungo i periodi ed i gruppi della tavola in modo ben definito ed identificano le caratteristiche di ciascun elemento in base al posto che occupa su di essa. Esistono quattro proprietà periodiche della tavola: il raggio atomico, l’elettronegatività, l’energia di ionizzazione e l’affinità elettronica.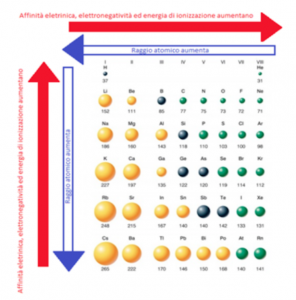
Il raggio atomico è determinato dalla metà della distanza tra i nuclei di due atomi uguali, varia aumentando lungo i gruppi (quindi verso il basso) e diminuisce lungo i periodi (quindi andando da sinistra verso destra). Per ricordare l’andamento di tutte le proprietà periodiche basta ricordarsi quella del raggio atomico poiché le altre variano in modo esattamente opposto.
L’elettronegatività indica la capacità di un atomo, facente parte di una molecola, di attrarre gli elettroni di legame. Più l’atomo è elettronegativo, più è probabile che gli elettroni di legame siano spostati verso tale atomo (anziché verso l’altro o gli altri atomi che fanno parte della molecola). Come già visto, l’andamento dell’elettronegatività varia esattamente in modo opposto rispetto al raggio, in particolare diminuisce lungo i gruppi (verso il basso) ed aumenta lungo i periodi (da sinistra verso destra).
Attenzione, ricordate sempre che l’idrogeno, nonostante sia a sinistra della tavola periodica, è un elemento comunque abbastanza elettronegativo. Questo spiega come mai il legame tra H e F, per esempio, sia di tipo covalente e non ionico. A tal proposito vale la pena fare una breve digressione e vedere come l’elettronegatività influenza i vari tipi di legame.
In particolare, il legame dipende dal valore che si ottiene effettuando la differenza di elettronegatività tra i due atomi coinvolti nel legame. Quando due atomi hanno una differenza di elettronegatività pari a zero ( → sono lo stesso atomo), o minore di 0,4, si parla di legame covalente puro.
Quando due atomi hanno una differenza di elettronegatività compresa tra 0,4 e 1,7/1,9 vuol dire che un atomo ha una forza nettamente più forte dell’altro nell’attrarre gli elettroni, ma che non ne ha a sufficienza per staccarli dall’atomo. Il tipo di legame sarà quindi di tipo covalente polare in quanto un atomo avrà richiamato su di sé gli elettroni di legame che andranno a costituire un parziale polo negativo, l’altro atomo avrà invece una parziale carica positiva.
Nel caso in cui due atomi abbiano una differenza di elettronegatività maggiore di 1,7/1,9 vuol dire che un atomo è abbastanza forte per staccare gli elettroni di legame e andare quindi a formare un anione con carica negativa e un catione con carica positiva. I due ioni con carica opposta poi si attrarranno e andranno a creare un legame di tipo ionico (elettrostatico). In particolare, l’anione è l’atomo che ha elettronegatività maggiore ed è quindi capace di richiamare su di sé gli elettroni di legame (carica negativa), il catione è invece l’atomo con elettronegatività minore ovvero quello che perde gli elettroni e sul quale prevalgono quindi le cariche positive.
Una volta capito come varia l’elettronegatività e dopo aver individuato gli elementi con elettronegatività maggiore sarà facile capire che tipo di legame intercorre tra i vari elementi.
Si ha poi l’energia di ionizzazione che prende in considerazione l’energia minima necessaria per allontanare un elettrone (idealmente all’infinito) e si misura in KJ / mol. Perdendo un elettrone l’atomo si trasforma in uno ione positivo (catione) che avrà un raggio atomico minore rispetto a quello precedente. Infatti, la carica positiva dei protoni non è più bilanciata da quella degli elettroni e quindi il catione riesce di conseguenza ad esercitare maggiormente la propria forza sugli elettroni rimasti. Proprio per questo motivo l’energia di seconda ionizzazione, necessaria a staccare un secondo elettrone dal catione, sarà più difficile. L’energia di ionizzazione varia in modo opposto al raggio in quanto più lontano si troveranno gli elettroni (quindi tanto maggiore sarà il raggio), tanto più facile sarà staccarli.
L’affinità elettronica è l’energia che viene liberata quando un atomo acquista un elettrone e si trasforma così in anione, si calcola in KJ / mol. NON è l’opposto dell’energia di ionizzazione.
ESERCIZIO 1
Sono riportati di seguito i valori dell’energia di prima, seconda, terza e quarta ionizzazione. Quale dei seguenti elementi è stato preso in considerazione?
Prima ionizzazione: 590 Kj/mol
Seconda ionizzazione: 1145 Kj/mol
Terza ionizzazione: 4912 Kj/mol
Quarta ionizzazione: 5700 Kj/mol
- Fluoro
- Carbonio
- Alluminio
- Calcio
- Litio
Si può notare una notevole differenza di energia tra i valori che determinano lo strappo del secondo e del terzo elettrone. Questo vuol dire che togliendo due elettroni si arriva ad avere la configurazione elettronica di un gas nobile, per cui (avendo l’ottetto completo) è molto difficile strappare un altro elettrone → servirà molta più energia per essere strappato via.
In altre parole, possiamo togliere un elettrone al calcio con la spesa di una piccola quantità di energia, facendolo diventare $Ca^+$. Al $Ca^+$ possiamo togliere un altro elettrone spendendo una quantità di energia poco superiore (+555 kJ / mol) rispetto alla precedente ed ottenere il $Ca^2+$. Al $Ca^2+$ possiamo togliere un altro elettrone spendendo una quantità di energia notevole (+3767 kJ / mol) rispetto al precedente passaggio, raggiungendo così la configurazione elettronica dell’argon (gas nobile). Togliere un altro elettrone sarà quindi molto più difficile e questo spiega come mai l’energia necessaria supera di oltre quattro volte la precedente. Nel fluoro avremmo notato questo gap tra l’energia di settima e di ottava ionizzazione. Nel carbonio, invece, fra l’energia di quarta e quinta ionizzazione, nell’alluminio tra quella di terza e quarta ionizzazione mentre nel litio tra l’energia di prima e seconda ionizzazione.
Risposta corretta D
ESERCIZIO 2
Il potassio ha:
A. Elettronegatività maggiore del litio
B. Raggio atomico minore dello zinco
C. Affinità elettronica minore del bario
D. Energia di ionizzazione uguale a quella del fluoro
E. Nessuna delle precedenti
Il litio ha elettronegatività maggiore del potassio in quanto tale proprietà diminuisce lungo i gruppi. Il bario ha affinità elettronica minore del potassio poiché anche questa caratteristica diminuisce lungo i gruppi. L’energia di ionizzazione aumenta lungo i periodi, per cui è impossibile che fluoro e potassio abbiano lo stesso valore. Il raggio atomico aumenta lungo i gruppi e diminuisce lungo i periodi ed è sbagliato quindi che il potassio abbia dimensioni minori dello zinco.
Risposta corretta E
Buono studio!